É ben sabido que no dogma central, o ARN é o mediador transcripcional entre a expresión do ADN e da proteína.En comparación coa detección de ADN, a detección de ARN pode reflectir de forma máis obxectiva a expresión dos xenes nos organismos.Os experimentos que inclúen ARN inclúen: qRT-PCR, ARN-Seq e detección de xenes de fusión, etc. En base ás características do propio ARN (o anel de azucre do ARN ten un grupo hidroxilo libre máis que o anel de azucre do ADN), xunto cunha gran cantidade de RNases no medio, o ARN é máis inestable e máis fácil de degradar que o ADN.Lixo dentro, lixo fóra, se a calidade do ARN non é boa, entón os resultados experimentais deben ser insatisfactorios, manifestados especificamente como datos inexactos ou mala repetibilidade.Polo tanto, débese prestar máis atención ao procesamento do ARN e a ligazón do control de calidade tamén é máis importante para garantir a precisión e exactitude dos datos experimentais posteriores.
Para o control de calidade do ARN, xeralmente hai os seguintes métodos de uso común:
- Espectrofotometría
- electroforese en xel de agarosa
- Bioanalizador Agilent
- PCR cuantitativa fluorescente en tempo real
- Método de tintura fluorescente Qubit
01 Espectrofotometría
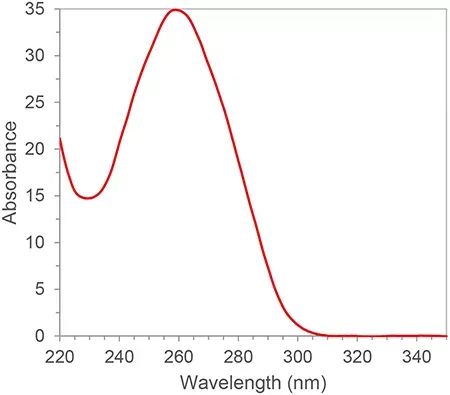
O ARN ten dobres enlaces conxugados e ten un pico de absorción a unha lonxitude de onda de 260 nm.Segundo a lei de Lambert-Beer, podemos calcular a concentración de ARN a partir do pico de absorción a 260 nm.Ademais, tamén podemos calcular a pureza do ARN segundo a relación de picos de absorción de 260 nm, 280 nm e 230 nm.280 nm e 230 nm son os picos de absorción de proteínas e moléculas pequenas, respectivamente.A proporción de A260/A280 e A260/A230 de pureza de ARN cualificada debe ser superior a 2. Se é inferior a 2, significa que hai contaminación por proteínas ou moléculas pequenas na mostra de ARN e que debe ser purificada de novo.As fontes de contaminación afectarán aos experimentos posteriores, como a inhibición da eficiencia de amplificación das reaccións de PCR, dando como resultado resultados cuantitativos inexactos.A pureza do ARN ten unha gran influencia nos resultados posteriores, polo que a espectrofotometría é xeralmente un vínculo de control de calidade indispensable no primeiro paso dos experimentos con ácidos nucleicos.
Figura 1. Espectro de absorción de ARN/ADN típico
02 Electroforese en xel de agarosa
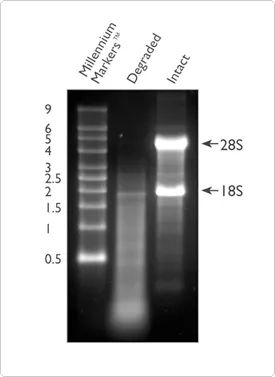
Ademais da pureza, a integridade do ARN tamén é un dos indicadores importantes para xulgar a calidade do ARN.A degradación do ARN dará lugar a un gran número de fragmentos curtos na mostra, polo que se reducirá o número de fragmentos de ARN que poden ser detectados e cubertos con eficacia pola secuencia de referencia.A integridade do ARN pódese comprobar mediante electroforese do ARN total nun xel de agarosa ao 1%.Este método pode configurar o xel vostede mesmo ou usar o sistema prefabricado E-Gel™ para probas de integridade.Máis do 80% do ARN total é ARN ribosómico, a maioría do cal está composto por ARNr 28S e 18S (en sistemas de mamíferos).O ARN de boa calidade mostrará dúas barras brillantes obvias, que son barras brillantes de 28S e 18S, respectivamente, a 5 Kb e 2 Kb, e a proporción tenderá a ser próxima a 2:1.Se está en estado difuso, significa que a mostra de ARN puido estar degradada, e recoméndase utilizar o método descrito máis adiante para probar máis a calidade do ARN.
Figura 2. Comparación de ARN degradado (carril 2) e intacto (carril 3) na electroforese en xel de agarosa
03 Bioanalizador Agilent
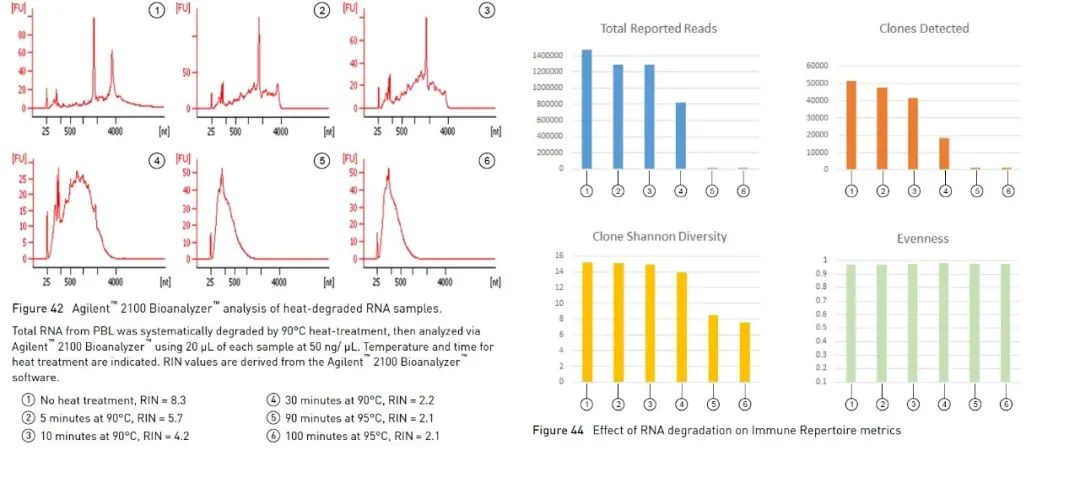
Ademais do método de electroforese en xel de agarosa descrito anteriormente, que pode axudarnos a identificar a integridade do ARN de forma sinxela e rápida, tamén podemos utilizar o bioanalizador Agilent para determinar a integridade do ARN.Usa unha combinación de microfluídica, electroforese capilar e fluorescencia para avaliar a concentración e integridade do ARN.Usando o algoritmo integrado para analizar o perfil da mostra de ARN, o bioanalizador Agilent pode calcular un valor de integridade do ARN de referencia, o Número de Integridade do ARN (en adiante denominado RIN) [1].Canto maior sexa o valor do RIN, maior será a integridade do ARN (1 está moi degradado, 10 é o máis completo).Algúns experimentos con ARN suxiren usar RIN como parámetro para a avaliación da calidade.Tomando como exemplo experimentos de secuenciación de alto rendemento (en adiante denominados NGS), as directrices de Oncomine™ Human Immune Repertoire, que se usan para detectar receptores de antíxenos de células B e T na serie de paneis Oncomine de Thermo Fisher, suxiren que se poden medir mostras con valores de RIN superiores a 4 (Figura 3).Existen diferentes intervalos recomendados para diferentes paneis, e moitas veces un RIN máis elevado pode achegar datos máis eficaces.
Na figura 3, nos experimentos de Oncomine™ Human Immune Repertoire, as mostras con RIN superior a 4 poden detectar lecturas máis eficaces e clons de células T.【2】
Non obstante, o valor RIN tamén ten algunhas limitacións.Aínda que RIN ten unha alta correlación coa calidade dos datos experimentais de NGS, non é adecuado para mostras de FFPE.As mostras de FFPE foron tratadas quimicamente durante moito tempo, e o ARN extraído xeralmente ten un valor de RIN relativamente baixo.Non obstante, isto non significa que os datos efectivos do experimento deban ser insatisfactorios.Para avaliar con precisión a calidade das mostras de FFPE, necesitamos utilizar medidas distintas do RIN.Ademais do RIN, o bioanalizador Agilent tamén pode calcular o valor DV200 como parámetro de avaliación da calidade do ARN.DV200 é un parámetro que calcula a proporción de fragmentos de máis de 200 pb nunha mostra de ARN.DV200 é un mellor indicador da calidade da mostra FFPE que RIN.Para o ARN extraído por FFPE, ten unha correlación moi alta co número de xenes que se poden detectar de forma efectiva e a diversidade de xenes [3].Aínda que DV200 pode compensar as deficiencias na detección de calidade de FFPE, o bioanalizador Agilent aínda non pode analizar exhaustivamente os problemas de calidade nas mostras de ARN, incluíndo se hai inhibidores nas mostras.Os propios inhibidores poden afectar a eficiencia de amplificación dos experimentos posteriores e reducir a cantidade de datos útiles.Para saber se hai un inhibidor na mostra, podemos adoptar o método de PCR cuantitativa fluorescente en tempo real que se describe a continuación.
04 PCR cuantitativa fluorescente en tempo real
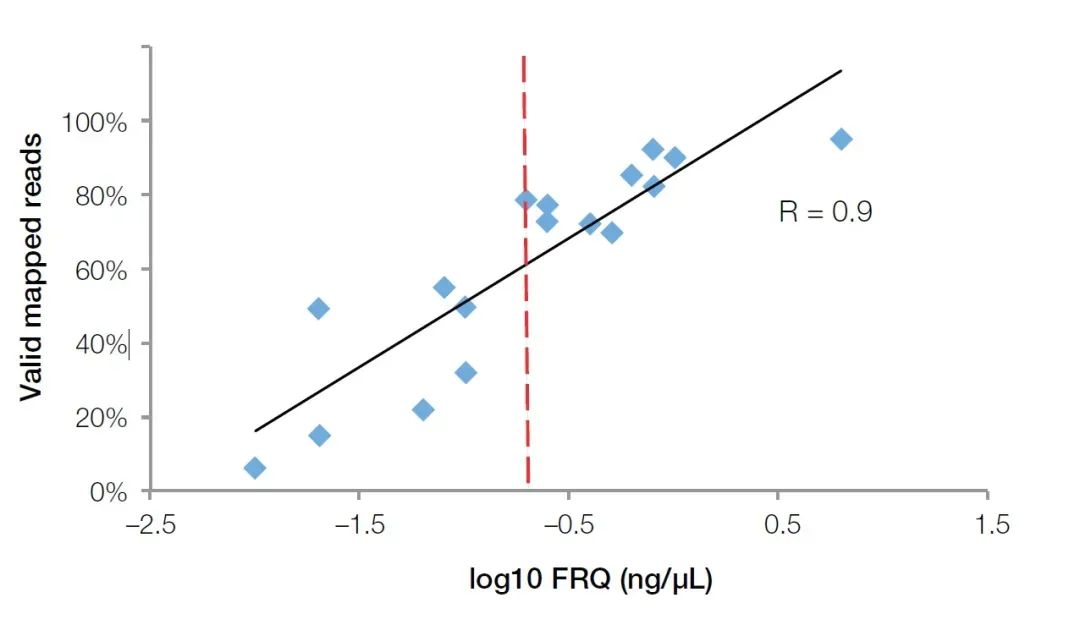
O método de PCR cuantitativa fluorescente en tempo real non só pode detectar os inhibidores da mostra, senón que tamén pode reflectir con precisión a calidade do ARN na mostra de FFPE.En comparación cos analizadores biolóxicos Agilent, os instrumentos cuantitativos de fluorescencia en tempo real son máis populares nos principais laboratorios biolóxicos debido á súa aplicación máis ampla.Para probar a calidade das mostras de ARN, só necesitamos comprar ou preparar sondas de cebador para xenes de referencia internos, como GUSB (núm. cat. Hs00939627).Usando este conxunto de cebadores, sondas e patróns (ARN total de concentración coñecida) para realizar experimentos cuantitativos absolutos, a concentración efectiva de fragmentos de ARN pódese calcular como o estándar de avaliación da calidade do ARN (Cuantificación de ARN funcional (FRQ) para abreviar).Nunha proba de NGS, descubrimos que o FRQ das mostras de ARN ten unha correlación moi alta co volume de datos efectivo.Para todas as mostras superiores a 0,2 ng/uL FRQ, polo menos o 70% das lecturas poden cubrir efectivamente a secuencia de referencia (Figura 4).
Figura 4, o valor de FRQ detectado polo método cuantitativo de fluorescencia ten unha correlación moi alta (R2>0,9) cos datos efectivos obtidos no experimento NGS.A liña vermella é o valor FRQ igual a 0,2 ng/uL (log10 = -0,7).【4】
Ademais de ser aplicable ás mostras de FFPE, o método de PCR cuantitativa en tempo real tamén pode controlar eficazmente os inhibidores nas mostras.Podemos engadir a mostra a detectar ao sistema de reacción con Control Positivo Interno (IPC) e o seu Ensaio, e despois realizar a cuantificación de fluorescencia para obter o valor Ct.Se o valor de Ct queda por detrás do valor de Ct na reacción sen mostra, indica que o inhibidor está presente na mostra e inhibe a eficacia de amplificación na reacción.
05 Método de tintura fluorescente Qubit
O fluorómetro Qubit é o pequeno dispositivo máis usado para a detección de concentración e pureza de ácidos nucleicos, que é fácil de manexar e que existe en case todos os laboratorios de bioloxía molecular.Calcula con precisión a concentración de ácido nucleico detectando e un colorante fluorescente de unión ao ácido nucleico (reactivo de detección Qubit).Qubit ten unha alta sensibilidade e especificidade, e pode cuantificar con precisión o ARN ata unha concentración de pg/µL.Ademais da coñecida capacidade de cuantificar con precisión a concentración de ácidos nucleicos, o último novo modelo de Thermo Fisher, Qubit 4.0, tamén pode detectar a integridade do ARN.O sistema de detección de ARN de Qubit 4.0 (ensaio ARN IQ) detecta a integridade do ARN detectando simultaneamente dous colorantes fluorescentes específicos.Estes dous colorantes fluorescentes poden unirse a fragmentos grandes e pequenos de ARN, respectivamente.Estes dous colorantes fluorescentes indican a proporción de grandes fragmentos de ARN na mostra, e a partir deste pódese calcular o valor de CI (Integridade e Calidade) que representa a calidade do ARN.O valor de coeficiente intelectual é aplicable tanto a mostras FFPE como a non FFPE, e ten unha gran influencia na calidade da secuenciación posterior.Tomando como exemplo os experimentos de NGS, nos experimentos de proba de ARN-Seq realizados na plataforma Ion torrent™, a maioría das mostras con valores de coeficiente intelectual superiores a 4 tiveron lecturas efectivas de polo menos o 50 % (Figura 5).En comparación cos métodos de detección mencionados anteriormente, o Ensaio Qubit IQ non só é máis cómodo de operar e leva menos tempo (dentro de cinco minutos), senón que tamén ten unha gran correlación entre o valor de IQ do parámetro medido e a calidade dos datos dos experimentos posteriores.
Na figura 5, hai unha gran correlación entre o valor de Qubit RNA IQ e as lecturas mapeadas de ARN-Seq.【5】
A través da introdución anterior, creo que todos teñen unha comprensión suficiente dos diferentes métodos de control de calidade do ARN.Na práctica, podes escoller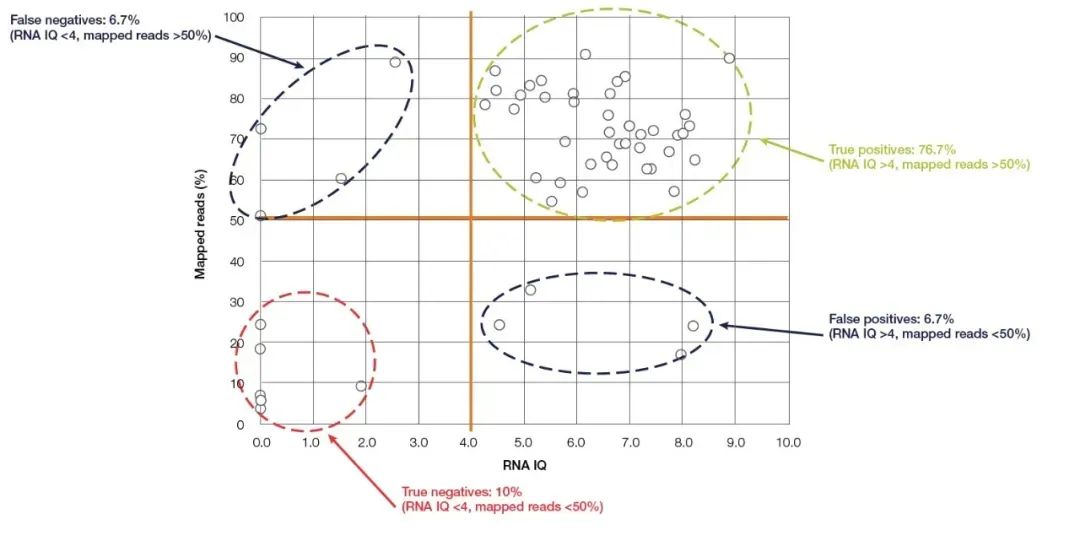 o método correspondente segundo o tipo de mostra e os instrumentos existentes.Só controlando ben a calidade do ARN podemos evitar o fracaso dos experimentos posteriores debido á mala calidade da mostra, aforrando así un tempo, enerxía e custos preciosos.
o método correspondente segundo o tipo de mostra e os instrumentos existentes.Só controlando ben a calidade do ARN podemos evitar o fracaso dos experimentos posteriores debido á mala calidade da mostra, aforrando así un tempo, enerxía e custos preciosos.
Produtos de referencia:
Kit de illamento de ARN total animal
Kit de illamento de ARN total celular
referencias
【1】Schroeder, A., Mueller, O., Stocker, S. et al.O RIN: un número de integridade de ARN para asignar valores de integridade ás medicións de ARN.BMC Molecular Biol 7, 3 (2006).https:// doi .org/10.1186/1471-21 99-7-3
【2】Guía do usuario do repertorio inmunitario humano de Oncomine (núm. de publicación MAN0017438 Rev. C.0).
【3】Leah C Wehmas, Charles E Wood, Brian N Chorley, Carole L Yauk, Gail M Nelson, Susan D Hester, Enhanced Quality Metrics for Assessing RNA Derived From Archival Formalin-Fixed Paraffin-Embedded Tissue Samples, Toxicological Sciences, Volume 170, August Issue, Issue 231-92 de agosto, páx.https://doi.org/10.1093/toxsci/
Hora de publicación: 12-Xun-2023