Nos experimentos de qPCR, o deseño de cebadores tamén é un vínculo moi importante.Se os cebadores son axeitados ou non está moi relacionado con se a eficiencia da amplificación alcanza o estándar, se os produtos amplificados son específicos e se os resultados experimentais están dispoñibles.
Entón, como mellorar a especificidade do cebador de qPCR?¿Alta eficiencia de amplificación?
Hoxe, levarémosvos a deseñar xuntos cebadores de qPCR e deixaremos que o deseño de cebadores de qPCR se converta nunha habilidade de tradición eficiente nos experimentos.
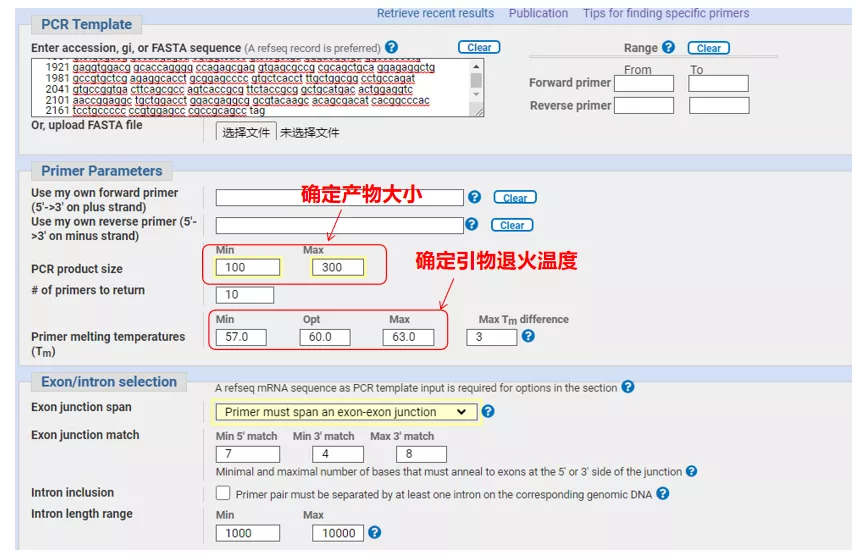
Ao deseñar cebadores de qPCR, adoita prestar atención aos seguintes puntos: os cebadores deben deseñarse a través de intróns o máximo posible, a lonxitude do produto debe ser de 100-300 pb, o valor de Tm debe estar o máis próximo posible a 60 °C e os cebadores augas arriba e augas abaixo deben estar o máis próximos posible, e o final do cebador debe ser G ou C, etc.
1. Deseño de cebadores que abranguen intróns
Cando se deseñan cebadores de qPCR, a elección de cebadores deseñados entre intróns pode evitar que o modelo de ADNg se amplifique, e todos os produtos derivan da amplificación do ADNc, eliminando así a influencia da contaminación do ADNg.
2. Lonxitude de imprimación
A lonxitude do cebador é xeralmente entre 18-30 nt, e a lonxitude do produto de amplificación debe controlarse entre 100-300 pb o máximo posible.
Se o cebador é demasiado curto, levará a unha amplificación inespecífica e, se é demasiado longo, formará facilmente unha estrutura secundaria (como a estrutura de horquilla).Se o produto de amplificación é demasiado longo, non é adecuado para a reacción da polimerase, o que afectará a eficiencia da amplificación por PCR.
3. Contido GC e valor Tm
O contido de GC dos cebadores debe controlarse entre un 40% e un 60%.Se é demasiado alto ou moi baixo, non é propicio para iniciar a reacción.O contido de GC dos cebadores directo e inverso debe ser próximo ao mesmo para obter o mesmo valor de Tm e temperatura de recocido.
O valor de Tm debe estar entre 55-65 °C na medida do posible, xeralmente ao redor de 60 °C, e o valor de Tm de augas arriba e augas abaixo debe ser o máis próximo posible, preferiblemente non máis de 4 °C.
4. Evite seleccionar A no extremo 3′ do cebador
Cando o extremo 3′ do cebador non coincide, hai grandes diferenzas na eficacia de síntese das diferentes bases.Cando a última base é A, tamén pode iniciar a síntese da cadea incluso no caso de desaxuste, e cando a última base é T Cando , a eficiencia da indución de desaxustes redúcese moito.Polo tanto, intente evitar escoller A no extremo 3′ do cebador, e é mellor escoller T.
Se se trata dun cebador de sonda, o extremo 5′ da sonda non pode ser G, porque mesmo cando unha soa base G está conectada ao grupo informador fluorescente FAM, G tamén pode apagar o sinal fluorescente emitido polo grupo FAM, dando como resultado resultados falsos negativos.Aparece.
5. Distribución base
A distribución das catro bases no cebador é preferentemente aleatoria, evitando máis de 3 G ou C consecutivos no extremo 3′, e máis de 3 consecutivos.G ou C son fáciles de xerar emparellamentos na rexión de secuencia rica en GC.
6. A rexión de deseño de imprimación debe evitar estruturas secundarias complexas.
A estrutura secundaria formada pola cadea única do produto de amplificación afectará ao suave progreso da PCR.Ao predicir con antelación se existe unha estrutura secundaria na secuencia diana, tenta evitar esta rexión no deseño dos cebadores.
7. Os propios cebadores e entre os cebadores deben tratar de evitar bases complementarias consecutivas.
Non pode haber complementariedade consecutiva de 4 bases entre o propio cebador e o cebador.O cebador en si non debe ter unha secuencia complementaria, se non, dobrarase para formar unha estrutura de horquilla, o que afectará á combinación de recocido do cebador e do molde.
Non poden existir secuencias complementarias entre cebadores augas arriba e augas abaixo.A complementariedade entre cebadores producirá dímeros de cebadores, o que reducirá a eficiencia da PCR e mesmo afectará á precisión cuantitativa.Se as estruturas de cebador-dímero e horquilla son inevitables, o valor △G non debe ser demasiado alto (debe ser inferior a 4,5 kcal/mol).
8. Os cebadores amplifican o produto específico obxectivo.
O obxectivo final da detección de qPCR é comprender a abundancia do xene diana.Se se produce unha amplificación inespecífica, a cuantificación será inexacta.Polo tanto, despois de deseñados os cebadores, BLAST debe probalos e a especificidade dos produtos compárase na base de datos de secuencias.
A continuación, tomamos o xen humano GAS6 (Growth stop specific 6) como exemplo para deseñar cebadores de qPCR.
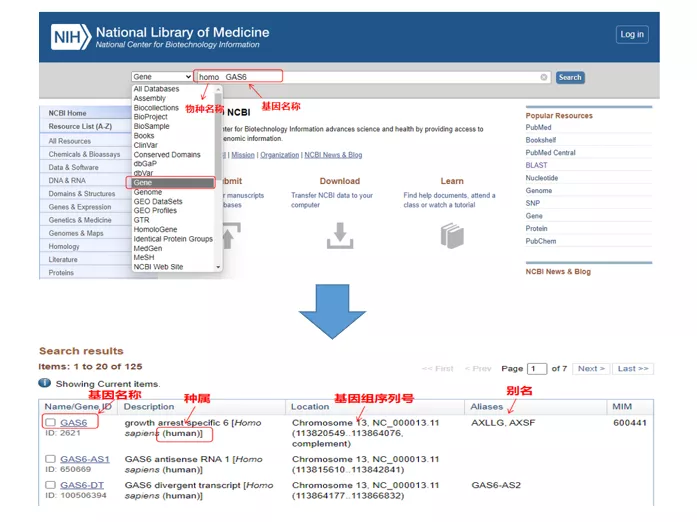
01 xene de consulta
Homo GAS6a través de NCBI.Aquí, debemos prestar atención a comparar o nome do xene e as especies para asegurarnos de que sexan consistentes.
 02 Atopa a secuencia de xenes
02 Atopa a secuencia de xenes
(1) Se a secuencia diana é ADN xenómico, seleccione a primeira, que é a secuencia de ADN xenómico do xene.
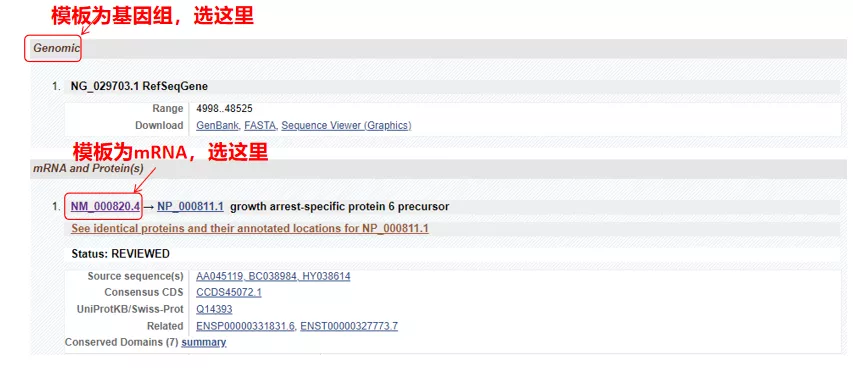 (2) Se a secuencia diana é ARNm, seleccione a segunda.Despois de ingresar, faga clic en "CDS" na táboa seguinte.A secuencia de fondo marrón é a secuencia codificante do xene.
(2) Se a secuencia diana é ARNm, seleccione a segunda.Despois de ingresar, faga clic en "CDS" na táboa seguinte.A secuencia de fondo marrón é a secuencia codificante do xene.
 03 Deseño de imprimacións
03 Deseño de imprimacións
Entra na interface Primer-BLAST
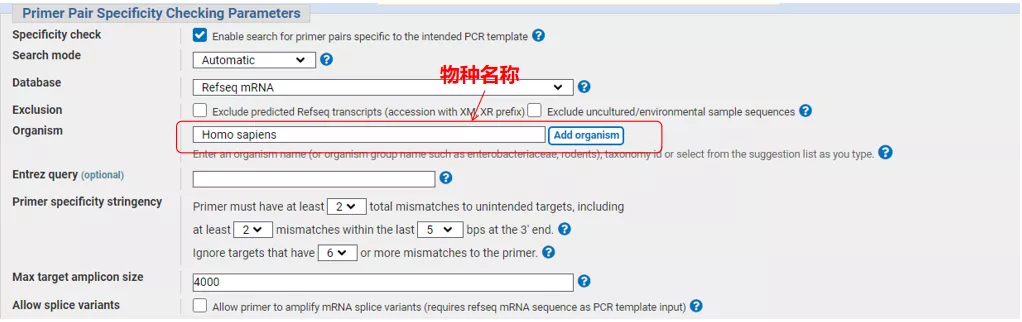
 Introduza o número de secuencia do xene ou a secuencia en formato Fasta na parte superior esquerda e enche os parámetros pertinentes.
Introduza o número de secuencia do xene ou a secuencia en formato Fasta na parte superior esquerda e enche os parámetros pertinentes.
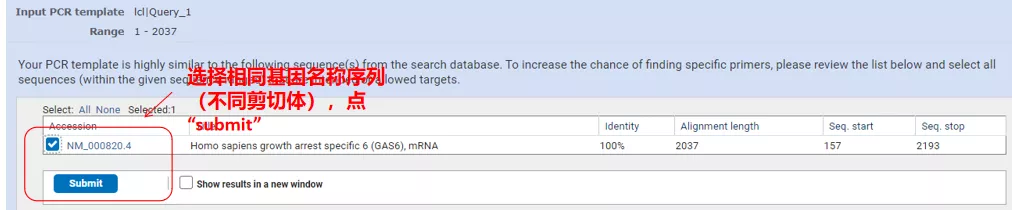
Fai clic en "Obter cebadores" e aparecerá NCBI para indicarche que esa selección de parámetros amplificarase a outras variantes de empalme.Podemos comprobar as diferentes variantes de empalme e envialas para obter o par de cebadores axeitado (como se mostra na figura a continuación).Este proceso pode tardar decenas de segundos en executarse.
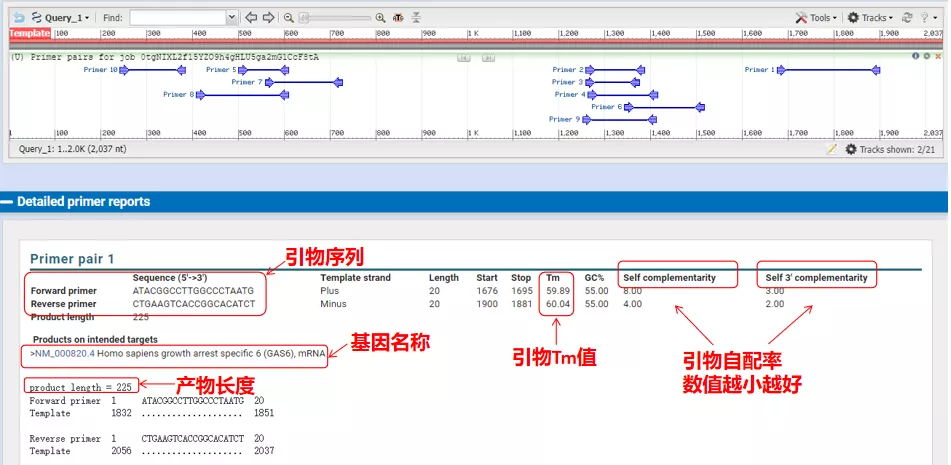 As temperaturas de recocido destes pares de cebadores son todos arredor dos 60 °C.Segundo o propósito do experimento, escolla cebadores cunha lonxitude moderada, boa especificidade e menos autocomplementación dos cebadores para o experimento, e a taxa de éxito é bastante alta.
As temperaturas de recocido destes pares de cebadores son todos arredor dos 60 °C.Segundo o propósito do experimento, escolla cebadores cunha lonxitude moderada, boa especificidade e menos autocomplementación dos cebadores para o experimento, e a taxa de éxito é bastante alta.
04 Verificación da especificidade da imprimación
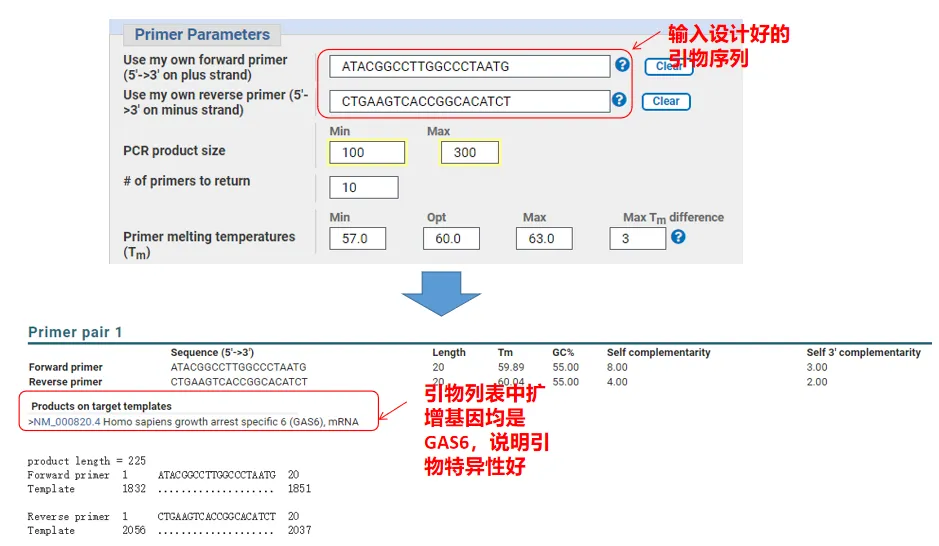
De feito, ademais de deseñar cebadores, Primer-Blast tamén pode avaliar os cebadores que deseñamos nós mesmos.Volve á páxina de deseño de cebadores, introduce os cebadores ascendentes e descendentes que deseñamos e non se axustarán outros parámetros.Despois de enviar, podes ver se o par de cebadores tamén existe noutros xenes.Se todos eles aparecen no xene que queremos amplificar, o que indica que a especificidade deste par de cebadores é xenial!(Por exemplo, este é o único resultado da consulta de cartilla!)
05 Xuízo de calidade inicial
Que tipo de cebador é o cebador "perfecto" que combina "eficiencia de amplificación ata o estándar", "características do produto amplificado" e "resultados experimentais fiables"?
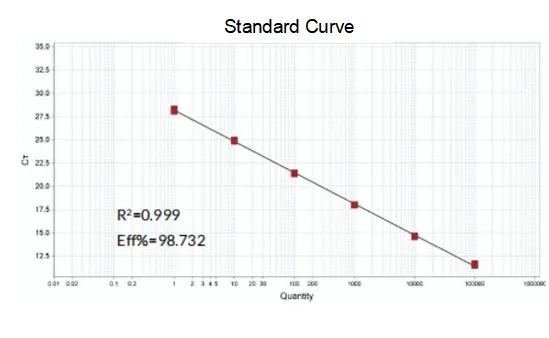 Eficiencia de amplificación
Eficiencia de amplificación
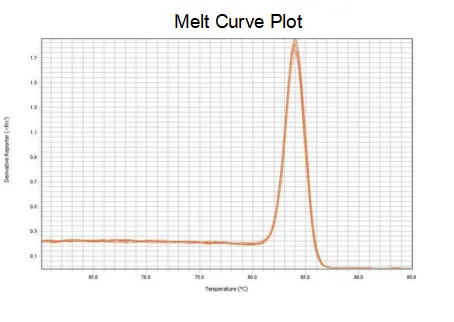 curva de fusión
curva de fusión
A eficiencia de amplificación dos cebadores alcanza o 90%-110%, o que significa que a eficiencia de amplificación é boa e a curva de fusión ten un único pico e normalmente Tm>80 °C, o que significa que a especificidade de amplificación é boa.
Produtos relacionados:
Real Time PCR Easy–SYBR GREEN I
PCR en tempo real Easy-Taqman
Hora de publicación: 10-feb-2023








