Os anticorpos, tamén chamados inmunoglobulinas (Ig), son glicoproteínas que se unen especificamente aos antíxenos.
A preparación de anticorpos convencional prodúcese inmunizando animais e recollendo antisuero.Polo tanto, o antisoero adoita conter anticorpos contra outros antíxenos non relacionados e outros compoñentes proteicos no soro.As moléculas de antíxenos xerais conteñen na súa maioría varios epítopos diferentes, polo que os anticorpos convencionais tamén son unha mestura de anticorpos contra múltiples epítopos diferentes.Mesmo os anticorpos séricos convencionais dirixidos contra o mesmo epítopo aínda están compostos por anticorpos heteroxéneos producidos por diferentes clons de células B.Polo tanto, os anticorpos séricos convencionais tamén se denominan anticorpos policlonais, ou anticorpos policlonais para abreviar.
O anticorpo monoclonal (anticorpo monoclonal) é un anticorpo moi uniforme producido por un só clon de células B e só dirixido contra un epítopo específico.Normalmente prepárase mediante tecnoloxía de hibridoma; a tecnoloxía de anticorpos de hibridoma baséase na tecnoloxía de fusión celular, que combina células B coa capacidade de segregar anticorpos específicos e células de mieloma con capacidade de crecemento infinita en hibridomas de células B.Esta célula de hibridoma ten as características dunha célula nai.Pode proliferar indefinidamente e inmortalmente in vitro como as células de mieloma, e pode sintetizar e segregar anticorpos específicos como os linfocitos esplénicos.Mediante a clonación pódese obter unha liña monoclonal derivada dunha única célula de hibridoma, é dicir, unha liña celular de hibridoma.Os anticorpos que produce son anticorpos altamente homoxéneos contra o mesmo determinante antixénico, é dicir, anticorpos monoclonais.
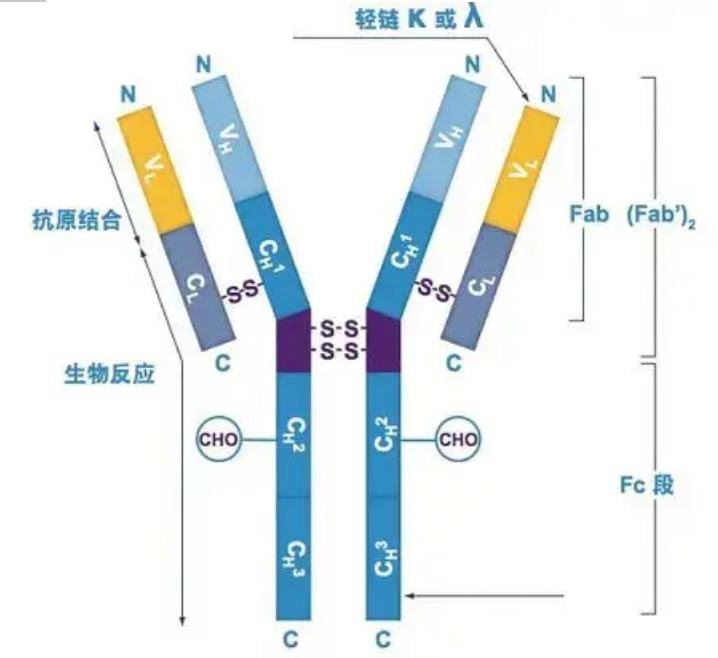
Os anticorpos existen como un ou máis monómeros en forma de Y (é dicir, anticorpos monoclonais ou anticorpos policlonais).Cada monómero en forma de Y está composto por 4 cadeas polipeptídicas, incluíndo dúas cadeas pesadas idénticas e dúas cadeas lixeiras idénticas.As cadeas lixeiras e pesadas chámanse segundo o seu peso molecular.A parte superior da estrutura en forma de Y é a rexión variable, que é o sitio de unión ao antíxeno.(Fragmento de Detai Bio-Monoclonal Antibody Concept)
Estrutura de anticorpos
 Cadea pesada
Cadea pesada
Hai cinco tipos de cadeas pesadas de Ig de mamíferos, nomeadas coas letras gregas α, δ, ε, γ e μ.Os anticorpos correspondentes chámanse IgA, IgD, IgE, IgG e IgM.As diferentes cadeas pesadas difiren en tamaño e composición.α e γ conteñen aproximadamente 450 aminoácidos, mentres que μ e ε conteñen aproximadamente 550 aminoácidos.
Cada cadea pesada ten dúas rexións: a rexión constante e a rexión variable.Todos os anticorpos do mesmo tipo teñen a mesma rexión constante, pero hai diferenzas entre anticorpos de diferentes tipos.As rexións constantes das cadeas pesadas γ, α e δ están compostas por tres dominios Ig en tándem, cunha rexión bisagra para aumentar a súa flexibilidade;as rexións constantes das cadeas pesadas μ e ε están compostas por 4 dominios Ig.A rexión variable da cadea pesada do anticorpo producido por diferentes células B é diferente, pero a rexión variable do anticorpo producido pola mesma célula B ou clon celular é a mesma, e a rexión variable de cada cadea pesada ten uns 110 aminoácidos de lonxitude., E formar un único dominio Ig.
Cadea lixeira
Só hai dous tipos de cadeas lixeiras nos mamíferos: tipo lambda e tipo kappa.Cada cadea lixeira ten dous dominios ligados: unha rexión constante e unha rexión variable.A lonxitude da cadea lixeira é duns 211 ~ 217 aminoácidos.As dúas cadeas lixeiras contidas en cada anticorpo son sempre iguais.Para os mamíferos, a cadea lixeira de cada anticorpo só ten un tipo: kappa ou lambda.Nalgúns vertebrados inferiores, como os peixes cartilaxinosos (peixes cartilaxinosos) e os peixes óseos, tamén se atopan outros tipos de cadeas lixeiras como o tipo iota (iota).
Segmentos Fab e Fc
O segmento Fc pódese combinar directamente con encimas ou colorantes fluorescentes para marcar anticorpos.É a parte onde o anticorpo se remacha na placa durante o proceso ELISA, e tamén é a parte onde o segundo anticorpo é recoñecido e unido na inmunoprecipitación, inmunotransferencia e inmunohistoquímica.Os anticorpos poden hidrolizarse en dous segmentos F(ab) e un segmento Fc por encimas proteolíticos como a papaína, ou poden romperse da rexión bisagra pola pepsina e hidrolizarse nun segmento F(ab)2 e un segmento Fc.Os fragmentos de anticorpos IgG ás veces son moi útiles.Debido á falta do segmento Fc, o segmento F(ab) non precipitará co antíxeno, nin será capturado por células inmunes en estudos in vivo.Debido aos pequenos fragmentos moleculares e á falta de función de enlace cruzado (debido á falta de segmento Fc), o segmento Fab úsase habitualmente para o radiomarcaxe en estudos funcionais, e o segmento Fc úsase principalmente como axente bloqueador na tinción histoquímica.
Rexións variables e constantes
A rexión variable (rexión V) está situada en 1/5 ou 1/4 (contendo uns 118 residuos de aminoácidos) da cadea H preto do extremo N-terminal e 1/2 (que contén uns 108-111 residuos de aminoácidos) preto do extremo N-terminal da cadea L.Cada rexión V ten un anel peptídico formado por enlaces disulfuro intracadena, e cada anel peptídico contén aproximadamente de 67 a 75 residuos de aminoácidos.A composición e a disposición dos aminoácidos na rexión V determinan a especificidade de unión ao antíxeno do anticorpo.Debido aos tipos e secuencias de aminoácidos en constante cambio na rexión V, pódense formar moitos tipos de anticorpos con diferentes especificidades de antíxeno de unión.As rexións V da cadea L e da cadea H chámanse VL e VH, respectivamente.En VL e VH, a composición e secuencia de aminoácidos dalgunhas rexións locais teñen un maior grao de variación.Estas rexións chámanse rexións hipervariables (HVR).A composición de aminoácidos e a disposición das partes non HVR na rexión V son relativamente conservadoras, o que se chama rexión marco.Hai tres rexións hipervariables na VL, normalmente situadas nos residuos de aminoácidos 24 a 34 e 89 a 97 respectivamente.Os tres HVR de VL e VH chámanse HVR1, HVR2 e HVR3, respectivamente.A investigación e análise da difracción de cristais de raios X demostraron que a rexión hipervariable é realmente o lugar onde se une o antíxeno do anticorpo, polo que chámase rexión que determina a complementariedade (CDR).Os HVR1, HVR2 e HVR3 de VL e VH pódense chamar CDR1, CDR2 e CDR3 respectivamente.Xeralmente, o CDR3 ten un maior grao de hipervariabilidade.A rexión hipervariable tamén é a principal localización onde existen os determinantes idiotípicos das moléculas de Ig.Na maioría dos casos, a cadea H xoga un papel máis importante na unión ao antíxeno.
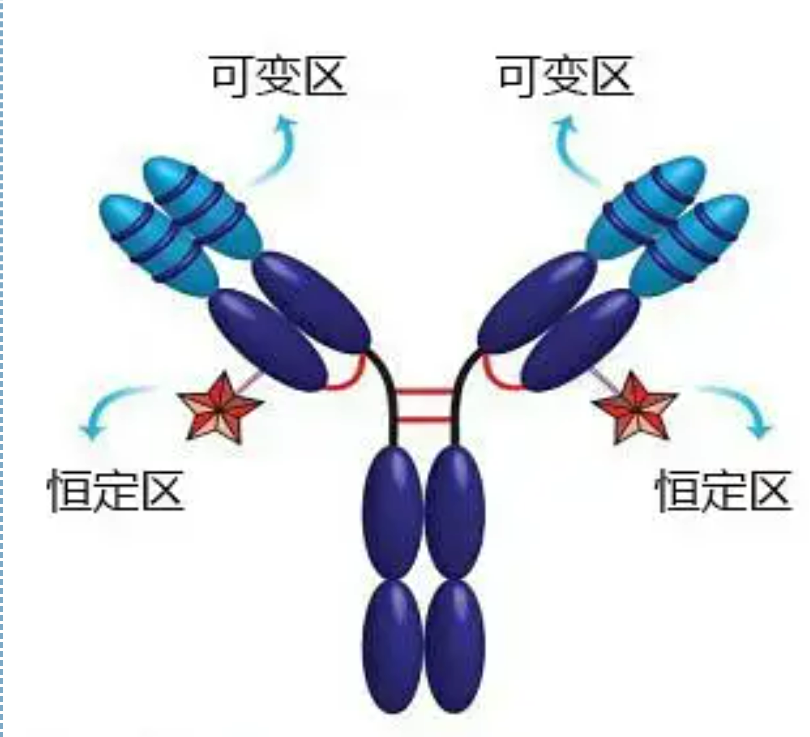 A rexión constante (rexión C)está situado a 3/4 ou 4/5 (aproximadamente do aminoácido 119 ao terminal C) da cadea H preto do extremo C terminal e 1/2 (contén uns 105 residuos de aminoácidos) preto do extremo C terminal da cadea L.Cada rexión funcional da cadea H contén uns 110 residuos de aminoácidos, e contén un anel peptídico composto de 50-60 residuos de aminoácidos conectados por enlaces disulfuro.A composición e disposición de aminoácidos desta rexión son relativamente constantes na mesma cadea de isotipo L de Ig animal e na mesma cadea de tipo H.O mesmo, só pode unirse especificamente ao antíxeno correspondente, pero a estrutura da súa rexión C é a mesma, é dicir, ten a mesma antixenicidade.O anticorpo secundario (ou anti-anticorpo) do cabalo anti-IgG humana pódese combinar cos dous. Prodúcese unha combinación de anticorpos (IgG) contra diferentes exotoxinas.Esta é unha base importante para preparar anticorpos secundarios e aplicar fluoresceína, isótopos, encimas e outros anticorpos marcados.
A rexión constante (rexión C)está situado a 3/4 ou 4/5 (aproximadamente do aminoácido 119 ao terminal C) da cadea H preto do extremo C terminal e 1/2 (contén uns 105 residuos de aminoácidos) preto do extremo C terminal da cadea L.Cada rexión funcional da cadea H contén uns 110 residuos de aminoácidos, e contén un anel peptídico composto de 50-60 residuos de aminoácidos conectados por enlaces disulfuro.A composición e disposición de aminoácidos desta rexión son relativamente constantes na mesma cadea de isotipo L de Ig animal e na mesma cadea de tipo H.O mesmo, só pode unirse especificamente ao antíxeno correspondente, pero a estrutura da súa rexión C é a mesma, é dicir, ten a mesma antixenicidade.O anticorpo secundario (ou anti-anticorpo) do cabalo anti-IgG humana pódese combinar cos dous. Prodúcese unha combinación de anticorpos (IgG) contra diferentes exotoxinas.Esta é unha base importante para preparar anticorpos secundarios e aplicar fluoresceína, isótopos, encimas e outros anticorpos marcados.
Produtos relacionados:
Kit Cell Direct RT-qPCR
Hora de publicación: 30-09-2021








